Оптимизация технологии биоремедиации сельскохозяйственных земель, загрязненных гербицидом «Гезагард»
Проведена оптимизация технологий восстановления земель, загрязненных пестициами, для черноземных почв. Дана оценка эффективности ремедиации почвы при использовании различных технологий.
УДК 579.64
В. В. Олискевич, Н. М. Талаловская, С. Э. Третьякова, Е. А. Барышникова, О. Ю. Ксенофонтова, В. А. Гребенщикова, И. Ю. Андрюхина, Е. В. Басова, М. И. Правдивцева, Ю. А. Живайкина,
Е. В. Иванова
Научно-исследовательский институт технологий органической
и неорганической химии и биотехнологий (НИИТОНХ и БТ), Саратов
Саратовский государственный университет имени Н.Г. Чернышевского
Проведена оптимизация технологий восстановления земель, загрязненных пестициами, для черноземных почв. Дана оценка эффективности ремедиации почвы при использовании различных технологий. Изучена биологическая активность почвы в условиях загрязнения гербицидом «Гезагард» и определена скорость деградации пестицида при использовании следующих технологических приемов: стимулирование автохтонной микрофлоры агротехническими приемами (рыхление, полив, внесение углеводно-минеральной добавки) и внесение капсулированного и некапсулированного микроорганизма – деструктора пестицида Pseudomonas putida П2.
Ключевые слова: технологии биоремедиации, пестицид «Гезагард», прометрин, микроорганизмы деструкторы, рекультивация земель, загрязнение пестицидами, деструктор Pseudomonas putida.
Optimization Technology Bioremediation Agricultural Land
of Contaminated of Herbicide «Gezagard»
V. V. Oliskevich, N. M. Talalovskaya, S. E. Tretyakova,
E. A. Baryshnikova, O. U. Ksenofontova,
V. A. Grebenshchikova, I. Y. Andryuhina, E. V. Basova,
M. I. Pravdivzheva, U. A. Zhivaikina, E. V. Ivanova
The optimization technology restoring land contaminated by pesticides, for black soil. Assessed the effectiveness of soil remediation using different technologies. Studied the biological activity of the soil contamination in the herbicide «Gezagard» and determined the rate of degradation of the pesticide with the following processing methods: stimulation of autochthonous microflora cultural practices (tillage, irrigation, application of carbohydrate-mineral supplements) and the introduction of encapsulated and non-encapsulated microorganism – destructor pesticide Pseudomonas putida P2.
Key words: bioremediation technology, the pesticide “Gezagard”, prometrin, microorganisms destructors, Pseudomonas putida, land reclamation, pollution pesticides.
В связи с интенсивным использованием химических средств защиты растений на сельхозугодьях, механической обработкой почвы и низким поступлением в почву органических остатков агроценозы характеризуются низкой биологической активностью, снижением плодородия и слабой самоочищающей способностью [1]. В результате большинство земель исключаются из сельскохозяйственного оборота вследствие накопления в них токсических поллютантов [2, 3]. Известно, что плодородие и самоочищение почв напрямую зависит от микробиологических процессов, однако в результате высокой интоксикации почвы автохтонная микрофлора зачастую не в состоянии справиться с загрязнением [4].
В настоящее время успешным решением проблемы восстановления плодородия являются разработка, освоение и оптимизация технологий ремедиации земель. Однако почвы, располагающиеся в различных климатических условиях, отличаются по физическому, химическому и микробиологическому составу. В результате эффективность разработанных методов рекультивации может резко отличаться для различных регионов и типов почв.
Цель данного исследования – оптимизация технологий ремедиации почв типа «чернозем южный» Нижнего Поволжья, загрязненной гербицидами.
В качестве модельного загрязнителя почвы был выбран гербицид сим-триазинового ряда «Гезагард» (производство «Сингента Кроп Протекшн АГ», Франция) с действующим веществом «Прометрин». Данный пестицид широко используется в растениеводстве на территории России и обладает широким спектром действия против однолетних двудольных и злаковых сорняков на посевах картофеля, капусты, злаковых и масличных культур [5]. Для получения высокого
загрязнения почвы вносили 0,1 мл гезагарда на 1 кг почвы, что соответствовало 50 мг/кг действующего вещества прометрина (100 ПДК/кг).
В ходе эксперимента предстояло изучить биологическую активность почвы в условиях загрязнения гербицидом «Гезагард» и определить скорость деградации пестицида при использовании следующих технологических приемов:
1) стимулирование автохтонной микрофлоры агротехническими приемами (рыхление, полив, внесение углеводно-минеральной добавки);
2) внесение капсулированного и некапсулированного микроорганизма – деструктора пестицида Pseudomonas putida П2 [6].
Работа выполнена на базе ООО «Научно-исследовательского института технологий органической и неорганической химии и биотехнологий (НИИТОНХ и БТ) г. Саратова.
Материалы и методы исследований
Подготовка земельного участка к испытаниям
Для разработки технологий ремедиации в полевых условиях был выбран земельный участок, содержащий почву типа «чернозем южный» (паспорт почвы составлен на базе аккредитованной лаборатории в ФБГУ Государственная станция агрохимической службы «Саратовская»). Перед полевыми испытаниями почва подвергалась механической обработке (фрезерование, боронование) и изучению физических и микробиологических характеристик. Санитарно-микробиологический анализ почвы проводили на базе аккредитованной лаборатории ФБУЗ «Центр гигиены и эпидемиологии в Саратовской области». Изучение численности и идентификацию микроорганизмов почвы проводили на кафедре микробиологии и физиологии растений биологического факультета СГУ.
Для оценки эффективности ремедиации почвы при использовании различных технологий экспериментальный участок земли был поделен на четыре площадки (табл. 1).
Таблица 1. Параметры и назначение земельных участков для ремедиации почвы при использовании различных технологий
|
Номер |
Параметры |
Назначение земельных участков |
|
1 |
10 x 2 |
Предназначен для внесения гезагарда и контроля его концентрации в почве, под воздействием абиогенных факторов окружающей среды и аборигенной микрофлоры.Служит «контролем» по отношению к участкам № 2, 3, 4 (загрязненный контроль) |
|
2 |
10 x 2 |
Предназначен для внесения гезагарда и контроля его концентрации в почве при проведении агроприемов (рыхление, полив, внесение углеводно-минеральной добавки) |
|
3 |
10 x 2 |
Предназначен для внесения гезагарда и контроля его концентрации в почве при проведении агроприемов и внесении некапсулированного деструктора прометрина Pseudomonas putida П2 |
|
4 |
10 x 2 |
Предназначен для внесения «Гезагарда» и контроля его концентрации в почве при проведении агроприемов и внесении капсулированного деструктора прометрина Pseudomonas putida П2 |
Технологический прием – стимулирование автохтонной микрофлоры
Для стимулирования естественной микрофлоры использовали следующие агротехнические приемы:
– рыхление почвы;
– полив и поддержание 30–40% влажности почвы от полной ее влагоемкости;
– внесение минерально-углеводной добавки, г/кг: аммиачная селитра – 0,3; нитроаммофоска – 0,3; сахароза – 1.
Влажность и влагоемкость почвы определяли гравиметрическим методом [7] и влагомерами модели TR–46908а.
Разрабатываемые агроприемы (полив, аэрация и внесение удобрений) проводили в слое почвы глубиной не более 0,12 м. В связи с этим для полива было рассчитано определенное количество воды (19,5 л на 1 м2), которое не проникало в слой почвы глубже 0,1 м для исключения смыва пестицида в нижние слои грунта. Для поддержания влажности почвы 30–40% полив осуществляли с помощью специального откалиброванного навесного оборудования (рис. 1). Для исключения попадания излишней влаги с осадками экспериментальные участки укрывали тентами (рис. 2).


Технологический прием – внесение некапсулированного деструктора прометрина Pseudomonas putida П2
Наработку необходимого количества биопрепарата-деструктора проводили в ферментере при температуре 25–28 °С в течение 3 суток. Внесение полученной взвеси, содержащей 1,08 × 109 кл/мл штамма Pseudomonas putida П2, осуществляли путем распыления на поверхность почвы с помощью навесного оборудования, установленного на минитракторе (рис. 3 а, б).


Технологический прием – внесение капсулированного деструктора
Для приготовления капсулированного деструктора использовали микрокапсулы марки МКП (ТУ 2292–003–13525135–2009) (рис. 4 а, б), предоставленные разработчиком, и штамм – деструктор прометрина Pseudomonas putida П2.
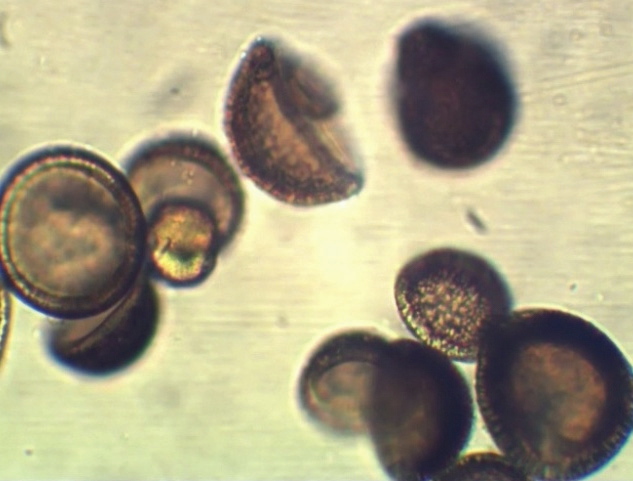
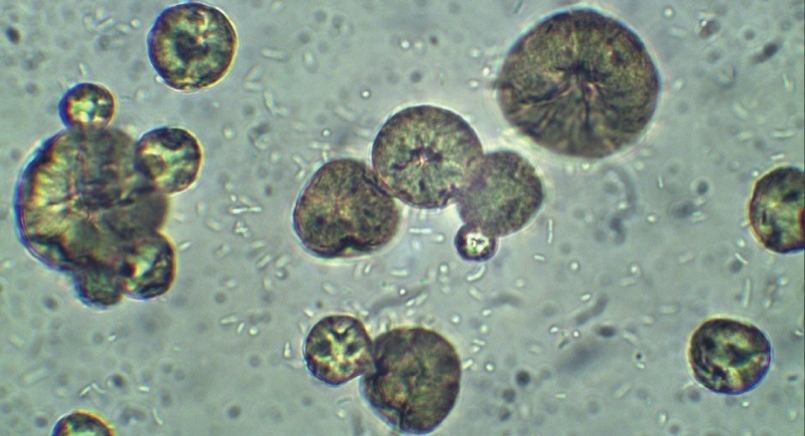
Рис. 4б. Микрокапсулы и адгезия клеток Pseudomonas putida на поверхности капсул при совместном культивировании в течение 2,5 ч. (ув. 1 : 15000)
Инокуляцию капсул деструктором проводили в соответствии с рекомендациями производителя, в которых требовалось проводить смешивание капсул и культуры бактерий в отношении 2,5 : 97,5% по массе и культивирование с бактериями в течение 2,5 ч. Конечная концентрация бактериальных клеток в суспензии с капсулами соответствовала ≈ 1–1,2 × 108 кл/мл. Для того чтобы исключить влияние сорбционных свойств капсул на общую динамику уменьшения концентрации ДВ прометрина в почве, была установлена их относительная сорбционная емкость (11,7 мг ДВ прометрина/1 г капсул). Внесение капсулированного микроорганизма-деструктора осуществляли путем распыления на поверхность почвы с помощью ранцевого опрыскивателя (рис. 5).

капсулированного штамма-деструктора
Определение микробиологического состава почвы и идентификацию выделенных культур проводили по стандартным методикам [8–11]. Содержание пестицида в почве определяли хромато-масс–спектрометрическим методом путем определения концентрации прометрина в режиме селективного детектирования характеристических ионов-аналитов в соответствии со стандартной аттестованной методикой выполнения измерений [12]. Условия хроматографической программы и режима масс-спектрометра подбирали экспериментально для прометрина, в соответствии с данными библиотеки спектров MS Search v.2.0.
Отбор образцов почв с экспериментальных участков проводили согласно нормативным документам [13].
Результаты и их обсуждение
Результат разрабатываемых технологических приемов оценивали по качественному и количественному составу почвенных микроорганизмов и химическим показателям остаточной концентрации пестицида.
Оценка микробиологической активности почвы
Бактериологические исследования были направлены на изучение численности и определение доминирующих видов среди гетеротрофных бактерий (аммонификаторов), актиномицетов, плесневых грибов, азотфиксирующих и целлюлозоразрушающих бактерий до проведения испытаний и после. Интерес к этим группам автохтонной микрофлоры был вызван их участием в процессах минерализации и гумусообразования [14–17].
Для оценки эффективности разрабатываемых технологических приемов проведен сравнительный анализ микробиологического состава почвы до проведения эксперимента на 1-е сутки и после – на 30-е сутки.
Учет численности микроорганизмов до применения технологий ремедиации проводили в средней пробе почвы со всех экспериментальных участков.
Анализ полученных результатов показал, что среди аммонификаторов 54% бактерий относились к роду Bacillus, среди которых доминировали виды B. cereus, B. megatherium и В. mesentericus. Остальные были представлены неспорообразующими бактериями родов Artrobacter, Micrococcus и Agromyces. Из актиномицетов наиболее часто выделялись представители групп Albus и Griseus. Среди микроскопических грибов доминировали виды родов Mucor, Реnicillium и Fusarium. Из азот-фиксирующих микроорганизмов чаще всего идентифицировались Azomonas agilis и Azotobacter chroococcum. Среди целлюлозоразрушающих микроорганизмов доминировали Cellulomonas и Cellvibrio (табл. 2).
Таблица 2. Численность микроорганизмов (м/о) почвы при проведении технологических приемов ремедиации
Примечание. 1 – участок почвы, загрязненный пестицидом; 2 – участок почвы, загрязненный пестицидом + агротехнические приемы; 3 – участок почвы, загрязненный пестицидом + агротехнические приемы + биодеструктор; 4 – участок почвы, загрязненный пестицидом + агротехнические приемы + биодеструктор + капсулы.
Оценка полученных результатов позволила выявить стимулирование биологической активности почвы при использовании всех изученных технологий. Доказано, что внесение деструктора пестицида на участках № 3 и № 4 приводит к увеличению видового разнообразия и наибольшей активизации процессов размножения микроорганизмов, осуществляющих детоксикацию почвы. Следует отметить тот факт, что внесение капсулированного препарата деструктора в меньшей концентрации, чем некапсулированного, благоприятно влияет на бактериальную микрофлору, содержащуюся в почве. Возможно, использование иммобилизированного на капсулах штамма позволяет длительно сохранять в почве высокий титр деструктора и осуществлять более
полную деградацию препарата. Интродукция штамма Pseudomonas putida П2 в почву не вызывала нарушения микробного баланса автохтонной микрофлоры, а наоборот, активизировала микробиологические процессы, ответственные за детоксикацию.
Оценка показателей концентраций пестицида
Для контроля концентрации пестицида отбор проб осуществляли сразу после внесения препарата, а также на 7-е, 14-е, 21-е и 30-е сутки.
Полученные данные представлены в табл. 3.
Таблица 3. Динамика изменения концентрации прометрина в почве экспериментальных участков
Исходя из полученных результатов можно отметить, что на участках № 1 и № 2 концентрация ДВ прометрина снизилась незначительно по сравнению с участками № 3 и № 4, где были
применены технологии рекультивации с использованием биодеструкторов и агроприемов. Применение агроприемов без использования биодеструкторов (участок № 2) не оказало заметного влияния на изменение концентрации ДВ прометрина в почве по сравнению с контрольным участком № 1. Наибольшая степень деструкции (80%) наблюдалась на участке № 4, на котором проводили агротехнические приемы и вносили капсулированный препарат.
Таким образом, на основании полученных результатов микробиологического и химического анализов образцов почв можно констатировать тот факт, что применение микрокапсулированного биопрепарата в сочетании с агроприемами наиболее эффективно по сравнению с другими вариантами процессов биоремедиации. Степень деструкции составила 70–80%. Применение только агроприемов без внесения деструктора стимулировало активность аборигенной микрофлоры в меньшей степени, а степень деструкции
не превышала 13,5%.
В связи с вышеизложенным для ремедиации земель Нижнего Поволжья типа «чернозем южный», загрязненных гербицидом «Гезагард», следует применять технологический прием, использованный на участке №4 (рыхление, полив, внесение биодеструктора в виде микрокапсулированного препарата), обеспечивающий оптимальные условия для деградации пестицида (табл. 4). Применение указанной технологии позволяет мак-
симально задействовать все механизмы очищения.
Таблица 4. Технологические приемы ремедиации почвы, загрязненной гербицидом «Гезагард»
Список литературы
1. Захаренко В. А. Гербициды. М. : Агропромиздат, 1990. 194 с.
2. Лебедева Г. Ф., Агапов В. И., Благовещенский Ю. Н., Самсонова В. П. Гербициды и почва. М. : Изд-во Моск. ун-та, 1990. 492 с.
3. Федоров Л. А., Яблоков А. В. Пестициды – токсический удар по биосфере и человеку. М. : Наука, 1999. 462 с.
4. Колупаев А. В., Ашихмина Т. Я., Широких И. Г. Реакция почвенных микромицетов на пестицидное загрязнение // Иммунология, аллергология, инфектология. 2009. № 2. С. 50–51.
5. Кочетков И. Н., Иванченко В. В., Борисов С. Ю. Гезагард, дуал-голд, фюзилад форте в защите посевов от сорняков // Cпециалисты АПК нового поколения: материалы IV Всерос. науч.-практ. конф. Саратов: СГАУ, 2010. С. 96–98.
6. Иванова Е. В., Ксенофонтова О. Ю. Почвенные микроорганизмы деструкторы «Прометрина» // Биотехнология : реальность и перспективы в сельском хозяйстве : материалы Междунар. науч.-практ. конф. Саратов : Изд-во «КУБиК», 2013. С. 253–255.
7. Козлова А. А. Учебная практика по физике почв : учеб.-метод. пособие. Иркутск : Изд-во ИГУ, 2009. 81 с.
8. Нетрусов А. И., Егорова М. А., Захарчук Л. М. и др. Большой практикум по микробиологии : учеб. пособие для студ. высш. учеб. заведений / под ред. А. И. Нетрусова. М. : Академия, 2005. 608 с.
9. Сидоров М. А., Скородумов Д. И., Федотов В. Б. Определитель зоопатогенных микроорганизмов / под ред. М. А. Сидорова. М. : Колос, 1995. 319 с.
10. Петерсон А. М., Чиров П. А. Практические рекомендации для идентификации сапрофитных и условно-патогенных бактерий по фенотипическим признакам : для студ. биол. фак-та. Саратов : Изд-во Сарат. ун-та, 2005. 20 с.
11. Саттон Д., Фотергилл А., Ринальди М. Определитель патогенных и условно патогенных грибов / пер. с англ. М. : Мир, 2001. 486 с.
12. РД 52.18.188–2001 Определение массовой доли триазиновых гербицидов симазина и прометрина в пробах почвы. URL: ecolan.com.ru/catalog/337/13385 (дата обращения: 12.01.13).
13. ГОСТ 17.4.4.02–84 Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа. URL: chem/ib.msk.vu/Chembooks/documentation/GOST_17.4.4.02-84.pdf (дата обращения: 12.01.13).
14. Звягинцев Д. Г. Почва и микроорганизмы. М. : Изд-во Моск. ун-та, 1987. 256 с.
15. Звягинцев Д. Г. Некоторые концепции строения и функционирования комплекса почвенных микроорганизмов // Вестн. Моск. ун-та. 1978. № 4. С. 63–72.
16. Звягинцев Д. Г. Успехи и современные проблемы почвенной микробиологии // Почвоведение. 1988. № 10. С. 44–51.
17. Звягинцев Д. Г., Бабьева И. П., Зенова Г. М. Биология почв. М. : Изд-во Моск. ун-та, 2005. 445 с.